Was sind Isotope?
In Struktur des Atoms haben wir verschiedene Arten von Atommodellen gesehen, wie das Thomson-Modell, das Rutherford-Modell usw., und von dort aus erhalten wir ein Verständnis der Begriffe Atommasse und Atomzahl. In der Natur haben Wissenschaftler mehrere Elemente gefunden, die dieselbe Atommasse oder dieselbe Ordnungszahl haben. Um diese Elemente klar zu verstehen, werden sie in mehrere Kategorien namens Isotope, Isobaren, Isotone usw. unterteilt.
Isotope
Stellen Sie sich zwei Objekte vor, die dieselbe Farbe und dasselbe physische Aussehen haben, und Sie können sie nicht voneinander unterscheiden. Wenn man jedoch die Gewichte dieser beiden Elemente vergleicht, stellt sich heraus, dass sie unterschiedlich sind. Dieses Beispiel könnte Ihnen helfen, die Idee von Isotopen zu verstehen.
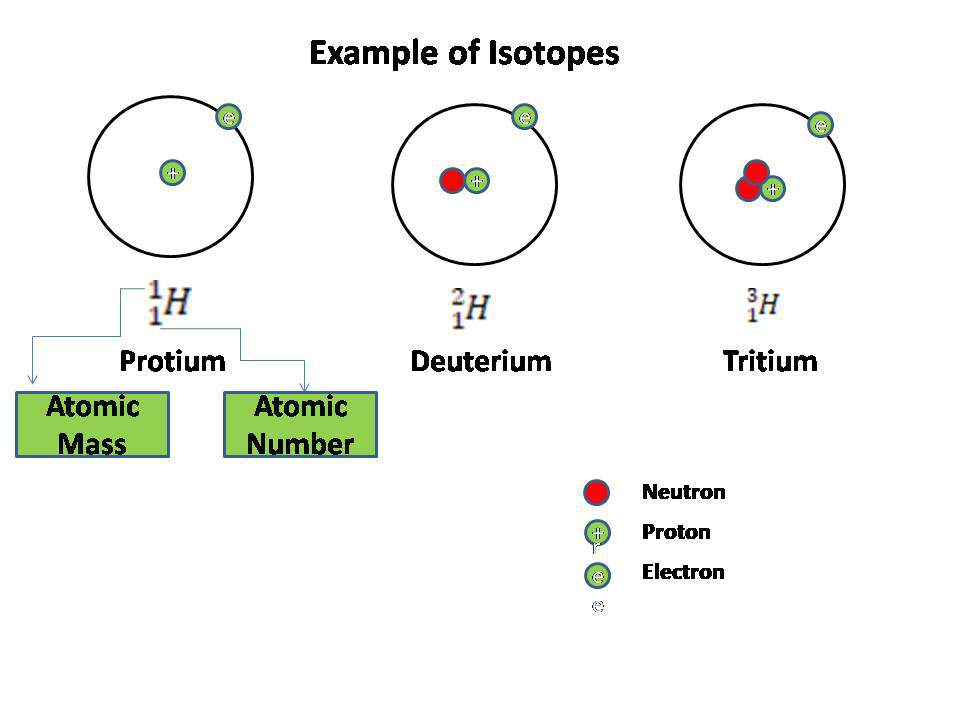
Wie wir alle wissen, bestehen Atome aus Elektronen, Protonen und Neutronen. Der Kern besteht aus Protonen und Neutronen, während Elektronen ihn umkreisen. Die Atommasse ist die Summe einer Anzahl von Protonen und Neutronen, während die Ordnungszahl gleich der Anzahl der Protonen ist. Die Anzahl der Protonen in einem Element ist konstant, während die Anzahl der Neutronen variiert.
Isotope sind Atome, in denen die Anzahl der Neutronen variiert, die Anzahl der Protonen jedoch konstant bleibt. Basierend auf den oben angegebenen Definitionen von Atommasse und Ordnungszahl können wir ableiten, dass Isotope Elemente sind, die die gleiche Ordnungszahl, aber eine unterschiedliche Massenzahl haben.
Oder mit anderen Worten: Elemente, die die gleiche Anzahl an Protonen, aber eine unterschiedliche Anzahl an Neutronen haben, werden als Isotope bezeichnet. zB 1 H 1 (Protium), 2 H 1 (Deutetrium) , 3 H 1 (Tritium) sind Isotope von Wasserstoff.
Anwendungen radioaktiver Isotope
Radioaktive Isotope haben mehrere Anwendungen. Im Allgemeinen sind sie jedoch nützlich, weil wir entweder ihre Radioaktivität nachweisen oder die von ihnen freigesetzte Energie nutzen können. Sie werden häufig in der Medizin, Industrie und Landwirtschaft für verschiedene nützliche Zwecke verwendet. Die Hauptaufgabe von Radioisotopen besteht darin, dass sie als Tracer verwendet werden .
Tracer sind chemische Verbindungen, in denen ein oder mehrere Atome durch ein Radionuklid ersetzt wurden, sodass sie aufgrund ihres radioaktiven Zerfalls verwendet werden, um den Weg von Radioisotopen zu verfolgen, und haben daher mehrere Verwendungszwecke.
Im Folgenden sind die Anwendungen von radioaktiven Isotopen aufgeführt:
- Radioaktive Datierung: Die Radiokohlenstoffdatierung, die das Alter von kohlenstoffhaltigen Objekten bestimmt, verwendet das radioaktive Isotop Kohlenstoff-14. Da die Halbwertszeiten radioaktiver Isotope nicht von externen Variablen beeinflusst werden, fungiert das Isotop als interne Uhr.
- Bestrahlung von Lebensmitteln: Einige radioaktive Verbindungen erzeugen Strahlung, die zur Zerstörung von Keimen auf einer Reihe von Waren verwendet werden kann, wodurch deren Haltbarkeit verlängert wird. Tomaten, Pilze, Sprossen und Beeren werden alle mit Kobalt-60- oder Cäsium-137-Emissionen bestrahlt.
- Medizinische Anwendungen: Radioaktive Isotope bieten eine breite Palette medizinischer Anwendungen, einschließlich der Diagnose und Behandlung von Krankheiten und Gebrechen. Beispielsweise wird 32 P zur Krebserkennung und -therapie, insbesondere in den Augen und der Haut, 59 Fe zur Anämiediagnose, 60 Co zur Gammastrahlenbestrahlung von Tumoren, 131 I zur Diagnose und Behandlung der Schilddrüsenfunktion und für viele weitere Anwendungen verwendet.
- Andere Verwendungen: Radioaktive Isotope finden Verwendung in der Landwirtschaft, Lebensmittelindustrie, Schädlingsbekämpfung, Archäologie und Medizin.
Isobaren
Isobaren sind Elemente, die unterschiedliche chemische Eigenschaften, aber die gleichen physikalischen Eigenschaften haben. Folglich sind Isobaren Elemente, die eine unterschiedliche Ordnungszahl, aber die gleiche Massenzahl haben. Ihre chemischen Eigenschaften unterscheiden sich aufgrund der Variation der Elektronenmenge. Es hat die gleiche Atommasse wie das andere, aber eine andere Ordnungszahl. Denn eine erhöhte Zahl an Neutronen gleicht den Unterschied in der Nukleonenzahl aus.
Elemente, die die gleiche Massenzahl oder man kann sagen, die gleiche Atommasse haben, werden als Isobaren bezeichnet. zB 40 Ar 18 (Argon) und 40 Ca 20 (Kalzium) sind Beispiele für Isobaren, da sie die gleiche Massenzahl haben (zB 40).

Beispiel Isobar
Anwendungen radioaktiver Isobaren
- Eine Isobare von Kobalt wird zur Behandlung von Krebs eingesetzt
- Eine Isobare von Phosphor wird zur Behandlung von Blutkrebs eingesetzt
- Jod wird zur Behandlung von Schilddrüsenerkrankungen eingesetzt
- Isobaren werden zur Behandlung von Tumoren, Blutgerinnseln usw. verwendet.
- Sie können auch in Meteorologie- und Wetterkarten verwendet werden.
Probleme basierend auf Isotopen und Isobaren
Aufgabe 1: Zwischen Isotopen und Isobaren unterscheiden?
Lösung:
Im Folgenden sind die Unterschiede zwischen Isotopen und Isobaren aufgeführt:
Isotope
Isobaren
1.
Isotope sind Atome mit gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl. Isobaren sind Atome verschiedener chemischer Elemente mit gleichen Werten für die Atommasse 2.
Isotope eines Elements haben die gleichen chemischen Eigenschaften Isobaren unterscheiden sich in ihren chemischen Eigenschaften 3.
Isotope kommen im Periodensystem an derselben Stelle vor. Isobaren treten an einer anderen Stelle im Periodensystem auf. 4.
Isotope haben unterschiedliche physikalische Eigenschaften Isobaren haben meist ähnliche physikalische Eigenschaften. 5.
Ähnliche Anordnung und Anzahl der Elektronen Die Anordnung der Elektronen ist unterschiedlich. 6.
Sie sind Atome desselben Elements. Sie sind Atome verschiedener Elemente.
Problem 2: Isotope haben die gleichen chemischen Eigenschaften, während Isobaren nicht die gleichen haben. Wieso den?
Lösung:
Isotope eines Elements haben die gleiche Anzahl von Elektronen und Protonen, aber eine unterschiedliche Anzahl von Neutronen. Da die chemischen Eigenschaften von Elementen von der Ordnungszahl abhängen, haben Isotope eines Elements ähnliche chemische Eigenschaften.
Auf der anderen Seite haben Isobaren die unterschiedliche Anzahl von Elektronen, Protonen sowie Neutronen.
Isobaren haben also unterschiedliche chemische Eigenschaften.
Aufgabe 3: Die Anzahl der Protonen und Elektronen ist in einem Atom gleich, warum ist es dann falsch zu sagen, dass die Ordnungszahl eines Atoms gleich seiner Elektronenzahl ist?
Lösung:
Es ist richtig zu sagen, dass die Ordnungszahl eines Atoms gleich nein ist. von Elektronen in diesem Atom, aber es ist nur für das neutrale Atom richtig, was bedeutet, dass das Atom weder positive noch negative Ladung hat. Wenn es ein Ion gibt, in dem entweder keine Elektronen kleiner oder größer als ein Elektron sind, dann können wir nicht sagen, dass die Ordnungszahl gleich der Anzahl der Elektronen ist.
Aufgabe 4: Was ist der Hauptunterschied zwischen radioaktivem Isotop und einfach dem Begriff Isotop?
Lösung:
Ein Isotop ist ein Atom eines Elements mit einer anderen Anzahl von Neutronen als das ursprüngliche Element. zB Kohlenstoff hat normalerweise 6 Neutronen. Ein Kohlenstoffisotop wäre Kohlenstoff 13. Dieses Atom ist ein Isotop, weil es 7 statt 6 Neutronen hat.
Radioisotop ist jedoch auch von Natur aus ein Isotop. Der Unterschied besteht darin, dass Radioisotope sehr instabil sind und einen hohen Anteil an Kernenergie enthalten und diese Energie in Form von Kernstrahlung abgeben. Der Hauptunterschied: Isotope können stabil oder instabil sein, aber Radioisotope sind immer instabil.
Aufgabe 5: Wie entstehen radioaktive Isotope?
Lösung:
Es gibt mehrere Quellen radioaktiver Isotope. Einige radioaktive Isotope sind als terrestrische Strahlung vorhanden. Radioaktive Isotope von Radium, Thorium und Uran kommen beispielsweise natürlicherweise in Gesteinen und Böden vor. Auch Uran und Thorium kommen in Spuren in Wasser vor. Radon, das durch den radioaktiven Zerfall von Radium entsteht, ist in der Luft vorhanden.
Organische Materialien enthalten typischerweise geringe Mengen an radioaktivem Kohlenstoff und Kalium. Kosmische Strahlung von der Sonne und anderen Sternen ist eine Quelle der Hintergrundstrahlung auf der Erde. Andere radioaktive Isotope werden vom Menschen durch Kernreaktionen erzeugt, die zu instabilen Kombinationen von Neutronen und Protonen führen. Eine Möglichkeit, eine Kerntransmutation künstlich herbeizuführen, besteht darin, stabile Isotope mit Alphateilchen zu bombardieren.
Aufgabe 6: Welche Isotope werden in der Krebsbehandlung eingesetzt und warum?
Lösung:
Yttrium-90 wird zur Behandlung von Krebs, insbesondere von Non-Hodgkin-Lymphomen und Leberkrebs, eingesetzt und wird weiter verbreitet, einschließlich zur Behandlung von Arthritis. Lu-177 und Y-90 werden zu den wichtigsten RNT-Agenten.
Eine große Strahlendosis verursachte Hautrötungen, Gewebeschäden, Strahlennekrose, Sterilität. Kleine Tiere könnten getötet werden. Solche Schäden an wachsender Materie deuteten darauf hin, dass Krebs durch die neue Strahlung behandelt werden könnte. Über die Ursache oder den Mechanismus von Krebs war wenig bekannt, aber seine Manifestation als unkontrollierbares „Wachstum“ war leicht zu erkennen, und Chirurgen behandelten Krebs, indem sie den erkrankten Teil wegschnitten. Kann Bestrahlung eine Operation ersetzen? Das Experiment zeigte, dass es anscheinend möglich war. Strahlung hemmte nicht nur das Wachstum dieser bösartigen Zellen, sondern schien auch wirksamer gegen sie zu sein als gegen normales Körpergewebe. Von dieser letzten glücklichen Tatsache hängt die erfolgreiche Behandlung von Krebs durch Bestrahlung ab. Sie ist die Grundlage für die Strahlentherapie, die neue medizinische Disziplin, die aus der Entdeckung von Röntgen hervorgegangen ist.